Ciclo do Ácido Cítrico
O ciclo do ácido cítrico, também denominado Ciclo de Krebs ou ciclo do Ácido
Tricarboxílico (TCA) realiza a oxidação de combustíveis metabólicos.
O ciclo do ácido cítrico é uma rota central para a recuperação de energia a partir de vários combustíveis metabólitos, incluindo carboidratos, ácidos graxos e aminoácidos, que são convertidos a acetil-CoA para a oxidação.
O ciclo fornece uma série de reagentes para uma variedade de rotas biossintéticas.
O ciclo é uma série de oito reações que oxida os grupos acetil do acetil-CoA, formando duas moléculas de CO2, de maneira que a energia livre liberada é conservada nos compostos reduzidos NADH e FADH2.
Seu nome é devido ao produto da primeira reação, o citrato. Uma volta completa produz três moléculas de NADH, uma de FADH2, um composto de alta energia (GTP ou ATP) e duas moléculas de CO2.
Sob condições aeróbicas, o piruvato entra na mitocôndria juntamente com H+ , através de uma proteína de transporte simporte (transporte de substâncias num mesmo sentido), para ser adicionalmente oxidado.
O piruvato é convertido a acetil-CoA pela piruvato desidrogenase na presença de NAD+ , a qual realiza uma descarboxilação oxidativa.
Os grupos acetil entram no ciclo como parte do composto de alta energia acetil-CoA (tio ésteres que possuem alta energia livre de hidrólise).
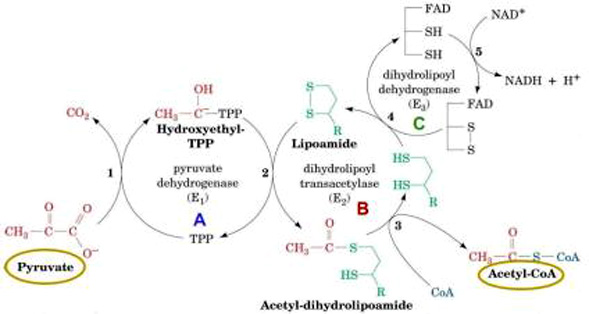
A piruvato desidrogenase é um complexo multienzimático (são grupos de enzimas associadas de modo não-covalente que catalisam duas ou mais reações sequenciais em uma rota metabólica).
Complexos multienzimáticos representam aumento da velocidade de reações enzimáticas, canalização dos intermediários metabólicos entre enzimas sucessivas, minimizando reações secundárias e as reações são controladas coordenadamente.
O complexo piruvato desidrogenase catalisa cinco reações sequenciais com a seguinte estequiometria:
Cinco coenzimas são necessárias: o pirofosfato de tiamina (TPP), a lipoamida, a coenzima A, o FAD e o NAD+ . O processo pode ser acompanhado na figura abaixo:
Processo de transformação do Piruvato ao Acetil-CoA através de um complexo multienzimático Enzima Reguladora: Citrato Sintetase
A síntese de citrato a partir de oxaloacteto e Acetil-CoA é uma condensação Aldol.
Esta enzima (CS) pode formar uma ligação C-C diretamente, na ausência de íons metálicos como cofatores.
Em procariontes, CS é composta de seis subunidades idênticas.
Em eucariontes, há duas isozimas (diferem na sequência de aminoácidos, mas que catalisam a mesma reação química): uma encontrada na matriz mitocondrial, e a segunda citoplasmática. Ambas parecem ser dímeros de cadeias idênticas.
Há um número de regiões similares na sequência da enzima em procariontes e eucariontes.
Uma das mais bem conservadas contém uma histidina que é um dos três resíduos envolvidos no mecanismo catalítico da enzima mitocondrial de vertebrados. Esta região é a utilizada como assinatura de reconhecimento.
Produtos: Os íons citratos formam sais denominados citratos com muitos íons metálicos. O citrato de cálcio ou “sal amargo”, por exemplo, é um importante citrato, que se utiliza geralmente na preservação e condimentação dos alimentos.
Além disso, os citratos podem quelar íons metálicos, e utilizar como conservantes e suavizadores de água. O íon citrato é importante também na biossíntese de Ácidos Graxos e do Colesterol.
A ligação do oxaloacetato provoca uma mudança conformacional que forma o sítio de ligação da acetil-CoA, fechando o sítio de ligação do oxaloacetato de maneira que o solvente não pode alcançar o substrato ligado.
A His274 e His320, em suas formas neutras, e a Asp375 estão como catalisadoras gerais ácido-base.
1- A etapa limitante é a formação do enol acetil-CoA, que é estabilizado por uma ligação de hidrogênio ao ânion His274 resultante.
O enol acetil-CoA ataca nucleofilicamente o carbono do grupo carbonil do oxaloacetato.
2 e 3- O intermediário resultante, a citril-CoA, é hidrolisado, produzindo citrato e CoA.
Etapa 02a: Enzima Reguladora: Aconitase (Aconitato hidratase)
A aconitase (também conhecida como Aconitato hidratase) é uma enzima metaloprotéica que catalisa a estereoisomerização reversível do citrato para o isocitrato via cis-aconitato no ciclo de Krebs.
Em eucariontes duas isozimas são atualmente conhecidas: uma encontrada na matriz mitocondrial e outra no citoplasma.
A família aconitase possui outras proteínas. Como assinatura de reconhecimento utilizam-se duas regiões conservadas que contém as três cisteínas ligadoras aos íons.
Produtos: O único produto é o cis-aconitato que é o intermediário na reação de citrato para a formação do isocitrato no ciclo de Krebs.
Cis-Aconitato Enzima reguladora: Aconitase (Aconitato hidratase)
Produtos: O isocitrato é um intermediário no Ciclo de Krebs.
Enzima reguladora: Isocitrato-desidrogenase
Esta enzima é importante no metabolismo de carboidratos, e cataliza a descarboxilação oxidativa de isocitrato em a-cetoglutarato. É dependente de NAD+ .
Em eucariontes há pelo menos 3 tipos desta enzima. Duas estão localizadas na matriz mitocondrial (uma dependente de NAD+ e outra dependente do NADP+ ) enquanto a terceira é citoplasmática.
A região melhor conservada destas enzimas é uma sequência de resíduos rica em glicina, localizada na porção C-terminal.
Estão relacionadas estruturalmente a esta enzima outras duas: A 3-isopropilmalato desidrogenase que cataliza o terceiro passo da biossíntese de leucina em bactérias e fungos; e a tartrado desidrogenase que cataliza a redução de tartrato a oxaloglicolato.
Produtos: O único produto formado é o Oxalosuccinato que é um intermediário no ciclo de Krebs. Também tem envolvimento no metabolismo do glioxalato e dicarboxilato ou em processo de fixação de carbono (Kyoto University).
Oxalosuccinato Enzima reguladora: Isocitrato-desidrogenase
Produtos: O -cetoglutarato é de fundamental importância em oxidação e biossínntese de aminoácidos, como no metabolismo do butanoato, do ascorbato e aldarato, na biossíntese da ubiquinona, degradação do triptofano e da lisina, entre outros.
Componente do complexo multienzimático 2-oxoglutaratodesidrogenase, responsável pela catálise da conversão total de a-cetoglutarato a succinil-CoA (um tioéster de alta energia) e CO2.
Este complexo contém múltiplas cópias de 3 componentes enzimáticos: E1 – a-cetoglutarato desidrogenase; E2 – dihidrilipoamida succiltransferase; E3 – Lipoamida desidrogenase. A regulação acontece por feedback dos catabólitos. Se localiza na matriz mitocondrial.
Produtos: Além de ser fundamental no ciclo de Krebs, o Succinil-CoA é formado na degradação de metionina, isoleucina, valina. Tem sua importância na biossíntese da Porfirina e em processos envolvendo bases piramídicas, ácidos graxos de cadeia ímpar, no metabolismo do propanoato e na fixação de gás carbônico, entre outros.
Etapa 05: GTP = Guanosina TriFosfato; GDP = Guanosina DiFosfato
Enzima reguladora: Succinil-CoA-Sintetase
Esta enzima acopla a clivagem da succinil-CoA de alta energia à sintese de um nucleosídeo trifosfato de alta energia: o GTP. ATP e GTP são rapidamente interconvertidos por meio da ação da nucleosídeo difosfatoquinase:
A reação ocorre em três etapas:
Ocorre a formação do Succinil-fosfato, um anidrido de alta energia.
Produtos: O Succinato se apresenta na síntese e degradação de corpos cetônicos, na síntese do aspartato, metionina, lisina e treonina, no metabolismo do propanoato, do butanoato e também na fixação de gás carbônico.
Até a quinta etapa, o equivalente a um acetil foi completamente oxidado em duas moléculas de CO2, dois NADH e um GTP foram gerados. Para completar o ciclo, o succinato deverá ser reconvertido a oxaloacetato. Esta conversão é alcançada pelas três reações restantes.
Formação do fosforil-His, um intermediário de alta energia, e o succinato.
Transferência do grupo fosforil para o GDP, formando GTP. Figura 10: Transferência do grupo fosforil para o GDP, formando GTP.
Enzima reguladora: Succinato desidrogenase
É centrada numa flavoproteína (FAD) contendo ferro-enxofre.
Em bactérias, dois distintos complexos enzimáticos ligados à membrana são responsáveis pela interconversão de fumarato com succinato e redução do FAD a FADH2.
Fumarato redutase é utilizada durante o crescimento anaeróbico.
Ambos consistem de dois componentes principais: um componente extrínseco à membrana composto de uma flavoproteína que liga-se ao FAD e uma proteína ferro-sulfúrica; e um componente hidrofóbico composto de uma proteína ancorada à membrana e/ou um citocromo B.
Em eucariontes a succinato desigrongenase mitocondrial é uma enzima composta de duas subunidades: uma FAD-flovaproteína e uma proteína ferro-sulfúrica.
A subunidade flavoproteína é uma proteína de 60 a 70KDa. O FAD está covalentemente ligado a um resíduo de histidina localizado na porção N-terminal da proteína.
A sequência ao redor desta histidina é bem conservada de bactérias a espécies eucarióticas, e pode ser utilizada para reconhecimento.
Produto: O Fumarato tem participação no ciclo da uréia, no ciclo do ácido cítrico, na síntese de ribonucleotídeos de bases púricas, na degradação de fenilalanina, tirosina e leucina, de benzoato via hidroxilação, entre outros processos.
Reação do Succinato
Em geral, o FAD oxida alcanos e alcenos, ao passo que o NAD+ participa em oxidações mais exotérmicas de álcoois e aldeídos ou cetonas.
Enzima reguladora: Fumarase (Fumarato hidratase)
As fumarato liases mostram uma curta sequência conservada ao redor de uma metionina provavelmente envolvida na atividade catalítica deste tipo de enzimas.
Especialmente a fumarase é uma enzima envolvida no ciclo de Krebs, que cataliza a hidratação de fumarato em L-Malato.
Produtos: O L-Malato se faz presente nos processos de neoglicogênese, no ciclo do Ácido cítrico, na fixação de carbono e de gás carbônico como também no metabolismo do glioxalato e dicarboxilato.
A succinato desidrogenase contém um FAD como grupo prostético covalente ligado a enzima por um resíduo de histidina.
A reação procede por meio de um estado transitório do carbânion. A adição do
OH- ocorre antes da adição do H+ para a formação do malato.
Enzima reguladora: Malato-desidrogenase
A malato-desidrogenase é uma enzima do ciclo de Krebs que cataliza a converão do malato em oxaloacetato (usando NAD+ ) via reação reversível.
Esta enzima também está envolvida na gliconeogênese, a síntese de glicose a partir de moléculas de menores dimensões.
O piruvato na mitocôndria sofre a ação da piruvato carboxilase para formar oxaloacetato, um intermediário do Ciclo de Krebs.
De modo a que o oxaloacetato seja colocado fora da mitocôndria, a malato-desidrogenase reduz o oxaloacetato em malato, que depois atravessa a membrana mitocondrial.
No citosol, o malato é oxidado em oxaloacetato pela malato-desidrogenase citosólica.
Produtos: O oxaloacetato é um -cetoácido presente no ciclo da uréia, do ácido cítrico na degradação de aspartato e asparagina, na gliconeogênese, na síntese de lisina e metionina entre outros processos relacionados.
Oxaloacetato
Reação do Fumarato
Por fim, temos uma visão geral do processo denominado Ciclo do Ácido Cítrico, mais comumente chamado de Ciclo de Krebs:
Reação do Malato
1- Dois átomos de carbono deixam o ciclo na forma de CO2.
Estes dois átomos que deixam o ciclo são diferentes dos que entraram na mesma volta (ou seja, não vieram do Acetil-CoA). 2- Cinco átomos de hidrogênio deixam o ciclo por volta, 3 como NADH e 2 como FADH2. 3- Duas moléculas de água são consumidas, uma na síntese do citrato e outra na hidratação do fumarato. 4- Quatro dos oito passos do processo são oxidações e a energia nelas liberada é conservada, com alta eficiência, na formação dos cofatores reduzidos (NADH e FADH2). 5- O NADH e o FADH2 produzidos no ciclo são oxidados pela cadeia transportadora de elétrons na membrana mitocondrial interna.
Para cada NADH oxidado formam-se aproximadamente 3 ATPs e para cada FADH2 formam-se 2 ATPs.
Portanto, quando os 3 NADH e o FADH2 são oxidados na cadeia transportadora de elétrons, formam-se 1 ATPs, mais um GTP formado diretamente.
Ou seja, 12 ligações fosfato de alta energia são formadas para cada acetil-CoA. 6- O oxigênio não participa diretamente do ciclo do ácido cítrico, porém o ciclo só funciona em aerobiose, porque o NAD+ e FAD só podem ser regenerados na mitocôndria pela transferência de elétrons ao oxigênio. Portanto, o ciclo do ácido cítrico é estritamente aeróbico.
Regulação do Ciclo do Ácido Cítrico
Os três mecanismos de controle do ciclo: (1) disponibilidade de substratos, (2) inibição pelo produto, (3) inibição competitiva da retroalimentação pelos intermediários ao longo do ciclo.
A necessidade de intermediários do ciclo do ácido cítrico como percussores biossintéticos e a demanda de ATP influenciam em sua operação. Os reguladores mais importantes são o Acetil-CoA, Oxaloacetato e o NADH.
O fluxo metabólico pela citrato sintetase varia com as concentrações dos substratos e é controlado pela disponibilidade destes substratos.
A concentração do Oxaloacetato está em equilíbrio com o malato e varia com a proporção
[NADH]/[NAD+ ], de acordo com a expressão:
A descarboxilação do piruvato pelo complexo da piruvato desidrogenase é irreversível e como não há outras vias para a síntese de Acetil-CoA a partir do piruvato em mamíferos, a reação deve ser controlada de modo preciso.
Há uma inibição deste processo pelos produtos NADH e Acetil-CoA que competem com o NAD+ e com a CoA pelos sítios de ligação nas respectivas enzimas.
Há regulação do ciclo também pela modificação covalente pela fosforilação/desfosforilação da enzima piruvato desidrogenase – a fosforilação inativa o complexo desta enzima.
Se a carga de trabalho aumenta, a concentração de NADH mitocondrial diminuirá e consequentemente, aumenta a concentração de oxaloacetato, estimulando a reação da citrato sintetase.
A taxa de consumo do citrato depende da atividade da isocitrato desidrogenase
NAD+ -dependente, a qual é fortemente inibida pelo produto NAD+ .
Outro exemplo de inibição pelo produto é a inibição da citrato sintetase pelo citrato, que compete com o oxaloacetato.
A succinil-CoA também compete com a acetil-CoA na reação da citrato sintetase, exemplo de inibição competitiva por retroalimentação.
Reações relacionadas ao Ciclo do Ácido Cítrico
Existem reações anfibólicas no ciclo do ácido cítrico e com seus produtos intermediários. Reações anfibólicas são reações de catabólicas e anabólicas.
Várias vias biossintéticas utilizam os intermediários do ciclo como reagentes para reações anabólicas.
Intermediários do ciclo que foram desviados podem ser reabastecidos por reações anapleróticas (reações de preenchimento).
A mais importante é catalisada pela piruvato carboxilase, que produz oxaloacetato a partir do piruvato.
Qualquer diminuição da velocidade do ciclo causada pela insuficiência de oxaloacetato ou outros intermediários leva a um aumento da concentração de acetil-CoA. Tal aumento ativa a piruvato carboxilase que reabastece o oxaloacetato.
Percebe-se, portanto, que uma série de reações intramitocondriais e extramitocondriais são necessárias para que se obtenha sucesso no ciclo.
Aqui você encontra Acido Citrico
Visite Nossa Loja online
Loja: www.soinsumos.com.br
Acido Citrico Fracionado